MYB-bHLH-WDR复合体对类黄酮合成的转录调控机制
作者:Wenjia Xu, Christian Dubos, and Loıuml;c Lepiniec
单位:1 Institut National de la Recherche Agronomique (INRA) Institut Jean-Pierre Bourgin, ERL-CNRS 3559, Saclay Plant Sciences, RD10,
78026 Versailles, France 2 AgroParisTech, Institut Jean-Pierre Bourgin, ERL-CNRS 3559, Saclay Plant Sciences, RD10, 78026 Versailles, France 3 INRA and Centre National de la Recherche Scientifique (CNRS) SupAgro-M, Universiteacute; Montpellier 2 (UM2), Biochimie et
Physiologie Moleacute; culaire des Plantes, 2 place Viala, 34060 Montpellier CEDEX 1, France
摘要:
黄酮类化合物以其在植物呈色中的作用,他们对植物耐受性和健康的贡献以及对食品质量的影响而广为人知。黄酮类化合物作为一种便利的生物标记,在遗传与表观遗传的大部分领域中发挥了重要的作用。本文综述了近年来黄酮类化合物生物合成调控机制的研究进展,重点介绍了MBW(MYB-bHLH-WDR)蛋白复合体。这些蛋白质在高等植物中高度保守。他们参与不同的调控途径,从环境因素的微调转录调控到通过正调节反馈启动类黄酮生物合成途径。MBW蛋白复合体为研究生长发育与环境控制的转录调控网络提供了有趣的模型。
类黄酮,生物学的“彩色模型”
结构和功能
类黄酮是最大的次生代谢产物之一,广泛分布于从种子植物到苔藓中。这些苯丙酸途径衍生物的主要类别包括黄酮醇、花青素和原花青素(PAS)。他们的结构多样性和抗氧化的特性决定了他们在植物与生物和非生物环境相互作用中的生理作用。此外越来越多的证据表明,黄酮类化合物和各种激素在控制种子大小和可育性等发育过程中交联。类黄酮还有助于提高植物产品在农业、工业上的以及营养价值。他们影响种子和果实的质量,植物产品的涩味以及食品的健康价值。最后,由于类黄酮的多样性和方便使用的特点,他为分析各种遗传、表观遗传、细胞、生物化学和进化过程提供了有用的模型,可能构成了植物中研究的最完善的代谢和调节途径之一。
生物合成途径的调控
类黄酮生物合成途径的第一个相关基因(即CHS、CHI、F3H以及F3rsquo;H)参与了常见前体(即,二氢黄酮醇)的产生,并被命名为早期生物合成基因(EBGs)。因此该通路的下游基因通常称为晚期生物合成基因(LBGs)。大多数相应的基因座都是基于容易检测到的影响种皮色素沉着的突变,即所谓的透明种皮突变。在拟南芥中类黄酮存在于所有组织中,而花青素和原花青素则分别在营养组织和种皮中积累。在营养组织中,类黄酮途径通常是在生理和环境波动的作用下诱导的,作为对病原菌感染、强光、紫外线、温度、干旱、盐、N、P或C营养引起的氧化应激的保护机制。有证据表明,不同的激素信号通路参与了这些调控[例如,脱落酸(ABA)、茉莉酸(JA)、或细胞分裂素(JA)的诱导,以及赤霉素(GA)、乙烯或油菜素甾体(BRs)的抑制。这些环境或生长发育的调控主要依赖于EBGs和LBGs的协同表达。因此,有六个tt基因编码转录调控因子,即TT2(MYB123)、TT8 (bHLH042), TTG1 (WDR家族), TT16 (ABS/AGL32, MADS box), TT1 (WIP1/Zn finger), and TTG2 (DSL1/ WRKY44),强调了转录调控在控制类黄酮生物合成中的重要性。TT1、TT16和TTG2也参与了表皮细胞生长,这揭示了TT1、TT16和TTG2可能间接控制了PA的积累。黄酮醇生物合成的调控涉及不同的以EBGs为靶基因的R2R3-MYB转录因子(TFs)以及黄酮醇合成酶(FLS),即MYB11,12以及111(分别称为PFG2,1和3)。本文就拟南芥TT2、TT8和TTG1的分子功能和调控及其同源的MYB、bHLH和WDR蛋白的研究进展进行综述。
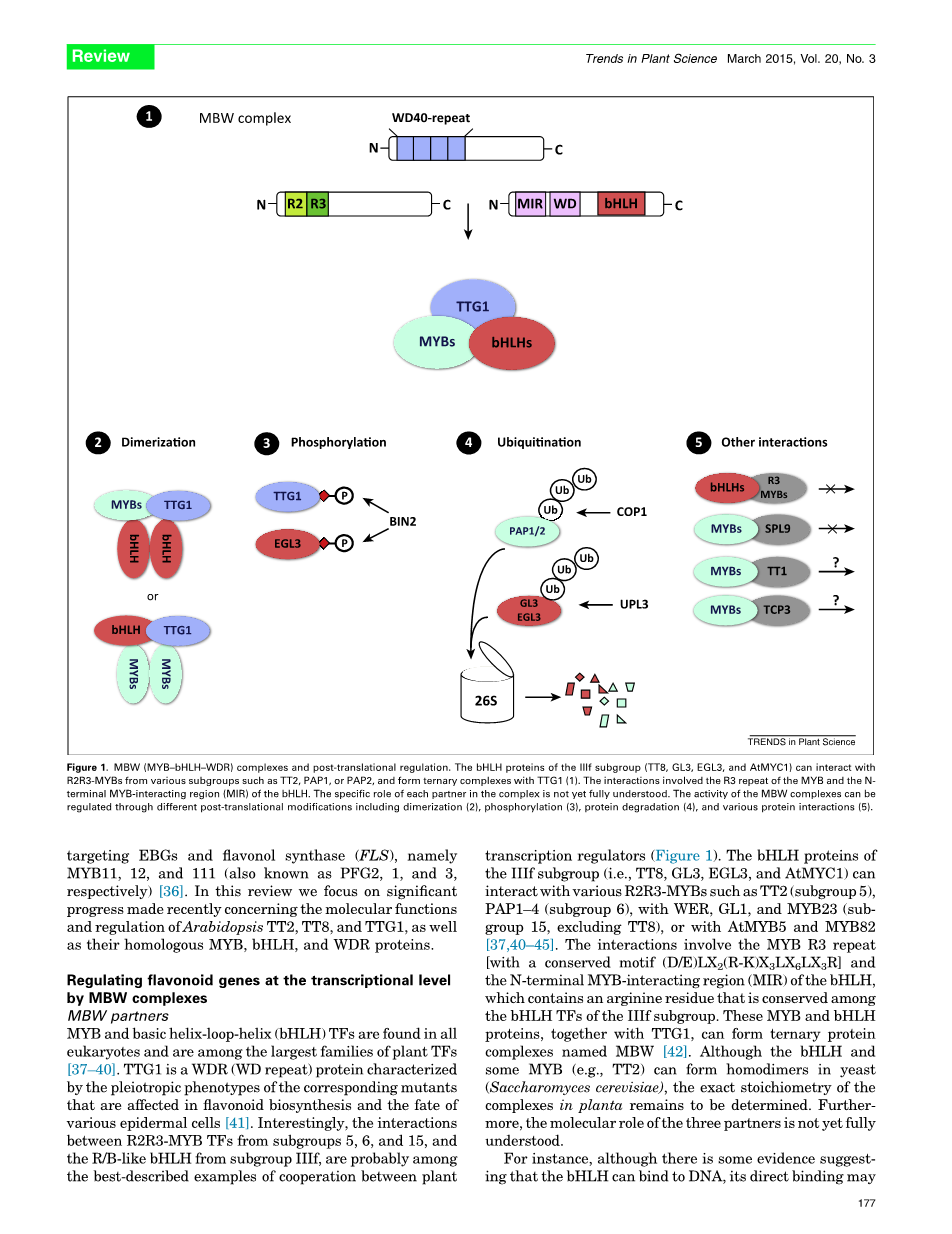
图一 MBW(MYB-bHLH-WDR)复合体及其翻译后调控。IIf亚科(TTG、GL3、EGL3和AtMYC1)的bHLH蛋白可以与TT2、PAP1或PAP2等不同亚科的R2R3-MYBs相互作用,并与TTG1形成三元复合体(1)。这种相互作用涉及到bHLH的MYB和N末端MYB相互作用区域(MIR)的R3重复。目前前尚未充分了解每个互作蛋白在复合体中的具体作用。MBW复合体的活性可以通过不同的翻译后修饰(包括二聚)来调节(2)。磷酸化(3)。蛋白质降解(4)。和各种蛋白质相互作用(5)。
MBW复合体在转录水平调控类黄酮基因的研究
MBW的互作蛋白
MYB和碱性环-螺旋-环转录因子普遍存在于所有真核生物中并且是植物最大的转录因子家族之一。TTG1是一种WDR(WD重复)蛋白,其特征是影响类黄酮生物合成的相应突变体的多向表型和各种表皮细胞的命运。有趣的是,来自第5、6和15亚科的R2R3-MYB转录因子与亚科IIIf类R/B bHLH之间的相互作用可能是植物转录调节中最好的协作例子。IIIf亚科(即TT8、GL3、EGL3和AtMYC1)的bHLH蛋白可与各种R2R3-MYB相互作用,如TT2(亚科5)PAP1-4(亚科6)、WER、GL1和MYB23(不包括TT8),或与AtMYB和MYB82相互作用。这种相互作用包括MYB R3重复[与保守的基序(D/E))LX2(R-K)X3LX6LX3R]和bHLH的N端MYB相互作用区(MIR),其中含有一个精氨酸残基,该残基在IIIF亚科的bHLH TFs中保守。这些MYB和bHLH蛋白以及TTG1可以形成三元蛋白复合体MBW。虽然bHLH和某些MYB(如TT2)可以在酵母(酿酒酵母)中形成同源二聚体,但植物中复合体的确切化学计量仍有待确定。此外,三个组分的分子作用尚未完全了解。
例如,虽然有证据表明bHLH可以与DNA结合,但它的直接结合可有可无。相反,MYB相互作用区域的突变可以诱导bHLH转录活性,表明MYB可能起调节作用。有趣的是,TTG1对植物MBW复合体的活性至关重要,而在酵母和苔藓原生质体中则是可有可无的。虽然不能排除异源蛋白可以取代酵母或苔藓中的TTG1,但有一种很有吸引力的假设认为,WDR蛋白是防止植物特异性抑制调节作用的必要条件。然而,这一假说并不能解释TTG1在苔藓和酵母中的积极作用。此外,不同bHLHs的异位表达也能(部分)补充ttg1突变体。这些结果表明,在植物中TTG1可以调节MBW复合体的特异性活性(即与其他蛋白质或DNA的相互作用和数量(如稳定性、定位)。
图二 MBW对种皮原花青素生物合成的调控作用。示意图表示的是正在发育中的种子。聚PA细胞定位于包被最内部的细胞层(即E,内皮、C,合点和M,珠孔区)。基因和蛋白质的名称用大写字母表示(用斜体表示基因),相应的突变体用小写斜体表示。缩写:DFR,二氢黄酮醇-4-还原酶;EGL3,GLABLE3子;LDOX,花青素双加氧酶;ANR花青素还原酶;GST,谷胱甘肽S-转移酶;LBG,晚期生物合成基因;MATE,多药毒性外排转运体;MBW,MYB-bHLH-WDR;PA,原花青素;TT1/2/8/16,透明种皮基因1、2、8、16;TTG1、2,透明光滑种皮基因1、2。弯曲箭头表明MBW复合体对TT8的细胞特异性表达有诱导作用。
MBW的功能以及DNA结合位点
PAs在种皮最里面的细胞层(即内皮细胞、合点部位细胞和珠孔)中的特异性积累,至少涉及四个MBW复合体,即TT2–TT8/GL3/EGL3–TTG1和 MYB5–TT8–TTG1,他们具有部分相似的功能。由TT2-TT8-TTg1组成的复合体在控制LBGs(DFR, LDOX, TT19, TT12, AHA10和BAN)的表达中起着重要的作用。MYB5-TT8-TTG1复合体在内皮细胞中具有调节DRF(二氢黄酮醇还原酶)、LDOX(白花青素双加氧酶)和TT12表达的活性,而TT2-EGL3/GL3-TTG1复合体对合点部位中LDOX、BAN(banyuls;花青苷还原酶)AHA10(自抑制H -ATPase亚型10)和DFR的表达有调节作用。植物组织中不同的MBW复合体对花青素的生物合成也有调节作用,包括产生花青素色素(PAP)1-4,GL3/ EGL3/TT8, 和TTG1。在这四个MYB类似物中PAP1起主要作用,因为PAP1功能的丧失导致幼苗花青素缺乏,而三种bHLHs(TT8、EGL3和GL3)表现出部分重叠的表达模式和冗余功能。遗传分析表明,MYB蛋白经常决定MBW复合体是否参与特定的通路。支持这一观点的MYB结构域的一些氨基酸残基可以解释MBW靶基因的特异性(例如,交换TT2和PAP4的特性)。MBW复合体所识别的MYB结合位点可分为两大类:MYB核心元件(5rsquo;至3rsquo;CNGTTR3,又称MBSI)和富含AC的部分([A/C]CC[A/T]A[A/C]),而bHLH与E/G-box (CANNTG/CACGTG)结合。最后,MBW复合体对不同目标的特异性很大程度上取决于R2R3-MYB和bHLH这两个组分的参与,以及其他调控因子的参与。例如,在对两个类黄酮基因的启动子,即BAN和TT8本身进行综合分析中,所定义的MYB-和bHLH-结合位点包括三种保守的顺式作用序列(即MYB-core, AC-rich, 以及E/G-box)。与这些发现相一致的是,在四个LBGs的功能启动子片段(DFR, TT19, TT12, AHA10)中,至少发现了每种类型的一个组分,这些启动子片段能在种皮中触发依赖于MBW的表达。然而,尽管在LDOX中也发现了两种类型的MYB结合位点的启动子,没有明显的bHLH结合位点,提示其他DNA基序和/或蛋白组分可能参与其中。在这方面,MBW互作蛋白的缺失可以特异性地抑制LBG的表达,但他们的异位表达可以激活整个类黄酮途径(在植物、酵母或苔藓中),为生物技术的应用铺平了道路。综上所述,这些结果表明,在植物体内,MBW对LBGs的特异性激活可能涉及到有待进一步研究的其他调节因子。
图三 TT8表达的复杂而高效的转录调控。TT8的启动子具有复杂的元件结构和部分冗余结构,与至少六个不同的MBW复合体相互作用。两个部分功能冗余的复合体(A,B)足以驱动花青素和PA积累细胞中TT8的表达,并以时空方式整合来自不同调控器的信号。第三个元件(C)负责启动子诱导的水平。对A元件进行了深入的功能分析,确定了三个功能顺势调节序列;一个MYB核心(CAGTTA)和一个G-box(CACGTC)是TT2-TT8-TTG1复合体的靶基因,以及一个富含AC的基序(也存在于元件B中),其调节器仍有待确定。直线箭头表示直接调节;虚线表示间接调节或多个步骤。TT1、TTG2、TT16和其他调节因子的作用仍有待确定。缩写如图二所示。
MBW复合体地翻译后调控
近年来,一些MBW蛋白的翻译后修饰被报道用于微调MBW复合体的转录活性。bHLH蛋白GL3和EGL3的积累受泛素/26S蛋白酶体(UPS)依赖的蛋白水解控制,涉及到HECT E3泛素连接酶UPL3/KAKTUS。有趣的是,GL3诱导UPL3表达会触发负调节反馈循环。同样,由COP1/SPA E3连接酶介导的UPS蛋白水解在黑暗中降解MYB蛋白PAP 1和PAP 2。TT8和TTg1也有可能成为蛋白酶体降解的靶基因,但目前还没有发现相关的E3连接酶蛋白。
少量R3-MYBs具有一个单一的R3结构域,且缺乏可能的激活结构域,可以抑制MBW的活性。它们可以与不同的bHLHs进行交互,就像MYBL 2与MYC 1、EGL 3、GL3和TT8一样。这些相互作用会破坏MBW复合体和/或复合体与DNA的结合。MYBL 2最近被证明是通过磷酸化来稳定的。同样,SPL9也通过与R2R3-mybs(pap1/3)的相互作用和靶基因启动子(Dfr)的结合,抑制花青素的生物合成。因此,针对PLA9的miR156可以间接诱导花青素途径基因的表达。TCP3是一种bHLH蛋白,通过与R2R3-MYBs(PAP 1、PAP 2和TT2)和MYBL2的相互作用,可以增强MBW的活性。玉米bHLH R与RIF 1(一种参与染色质重塑的蛋白)的二聚体和相互作用调节其活性。最近的研究表明,BRs诱导的GSK3样激酶BIN2可以通过磷酸化TTG1和EGL3/GL3来抑制MBW的活性。其他修饰,包括磷酸化、二硫键桥形成或半胱氨酸硝基化可能影响bHLH、MYB或TTG1的活性。但是,在大多数情况下,这些修饰对调节MBW活性的生物学意义仍有待于证明。
图四 MBW复合体通过激活晚期生物合成基因(LBG)的表达,参与类黄酮生物合成的发展和环境调控。这些转录调控网络的复杂性是非常显著的。它允许细胞特异性地积累各种黄酮类化合物,使其发挥不同的功能。种子的发育调节包括一个正反馈回
剩余内容已隐藏,支付完成后下载完整资料

英语原文共 10 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[597733],资料为PDF文档或Word文档,PDF文档可免费转换为Word
课题毕业论文、开题报告、任务书、外文翻译、程序设计、图纸设计等资料可联系客服协助查找。
您可能感兴趣的文章
- 饮用水微生物群:一个全面的时空研究,以监测巴黎供水系统的水质外文翻译资料
- 步进电机控制和摩擦模型对复杂机械系统精确定位的影响外文翻译资料
- 具有温湿度控制的开式阴极PEM燃料电池性能的提升外文翻译资料
- 警报定时系统对驾驶员行为的影响:调查驾驶员信任的差异以及根据警报定时对警报的响应外文翻译资料
- 门禁系统的零知识认证解决方案外文翻译资料
- 车辆废气及室外环境中悬浮微粒中有机磷的含量—-个案研究外文翻译资料
- ZigBee协议对城市风力涡轮机的无线监控: 支持应用软件和传感器模块外文翻译资料
- ZigBee系统在医疗保健中提供位置信息和传感器数据传输的方案外文翻译资料
- 基于PLC的模糊控制器在污水处理系统中的应用外文翻译资料
- 光伏并联最大功率点跟踪系统独立应用程序外文翻译资料



